Некоторое время назад на нашем сайте была размещена статья, в которой было проведено сравнение двух основных типов СО2-экстракции – докритической и сверхкритической. Этой публикацией, написанной в легком для понимания научно-популярном жанре, мы решили предварить появление более сложной для восприятия академической статьи, написанной нашими научными сотрудниками. И вот сейчас пришло время опубликовать вторую, уже академическую, статью, она предлагается вашему вниманию ниже, а с предыдущей статьей можно ознакомиться по этой ссылке. Знакомство с обеими статьями позволит вам получить объемное видение вопроса и научит понимать его по существу; а значит, также позволит и делать грамотный выбор между двумя разновидностями СО2-экстракции, в зависимости от существа стоящей перед вами задачи.
ТЕОРЕТИЧЕСКИЕ ПРЕДПОСЫЛКИ ВЫБОРА МЕТОДА ЭКСТРАКЦИИ РАСТИТЕЛЬНОГО СЫРЬЯ СЖИЖЕННЫМ ДИОКСИДОМ УГЛЕРОДА
А.А.Вьюков, Ю.В.Асатуров
На протяжении последних лет все чаще встречаются статьи, авторы которых приводят повторяющиеся описания достоинств сверхкритической (флюидной) экстракции растительного сырья сжиженным диоксидом углерода, а также тех или иных ее преимуществ перед докритической экстракции. Делая основной акцент на описание первой, и, либо частично, либо вовсе не приводя описание последней, авторы, в большинстве своем, без намека на объективность, незаслуженно критикуют докритическую экстракцию. Подобный подход к проблеме приводит к ошибочным выводам и часто вводит потребителей получаемых экстрактов в заблуждение. В связи с этим мы предприняли попытку абсолютно объективного рассмотрения этих технологий с точки зрения классических законов физики и химии.
Сжиженный диоксид углерода является неполярным растворителем. Он захватывает преимущественно неполярные группы органических природных соединений. Следовательно, СО2-экстракт это продукт, в состав которого входят преимущественно неполярные соединения. В зависимости от условий процесса экстракции диоксид углерода может быть как до – так и сверхкритическим. Объяснение тому – природа СО2.
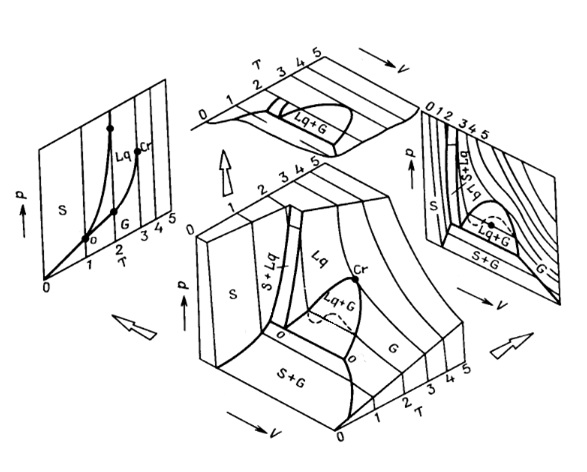
В основе процесса экстракции лежит диаграмма состояния Р (Т) однокомпонентной смеси диоксида углерода, имеющая следующий вид:
| S | – | твердая фаза | Р | – | Давление | |
| G | – | газ | Т | – | температура | |
| Lq | – | жидкость | V | – | объем | |
| o | – | тройная точка | ||||
| Cr | – | критическая точка |
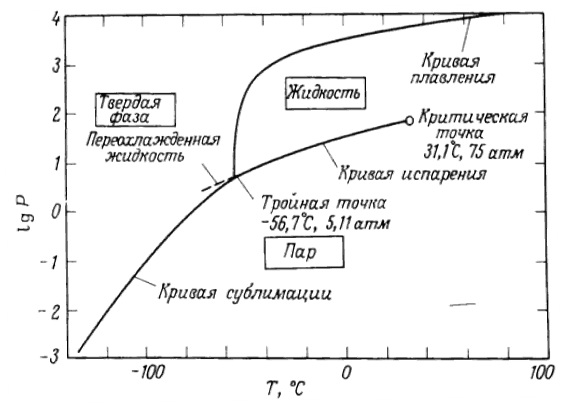
О диоксиде углерода имеется достаточное количество литературных данных. В частности говорится о том, что при давлении свыше 75 атм. и температуре более 31,1⁰С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным растворителем. Поэтому сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2000 дальтон: терпеновые соединения, воска, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины. Однако, абсолютно нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов.
Обладая подобными свойствами, сверхкритический диоксид углерода широко применяется в процессах экстракции, фракционирования, и импрегнации органических и неорганических веществ.
Утверждения об изменении полярных свойств диоксида углерода при переходе его во флюидное состояние нельзя назвать корректными, так как никаких физико-химических изменений молекула СО2 при этом не претерпевает. Добавление к СО2 сорастворителей с целью повышения эффективности экстракции и выхода продукта правомочно, но никак не сказывается на полярности углекислоты. За счет сорастворителей можно параллельно с неполярными соединениями экстрагировать полярные, но подобная смесь экстрактов обязательно расслоится, а наиболее активные соединения, например ненасыщенные жирные кислоты и достаточно агрессивные фруктовые кислоты вступят в соответствующие реакции.
Как известно, критическая температура и критическое давление СО2 – это та максимальная температура, при которой еще возможно сосуществование жидкой и паровой фазы. Стоит отметить, что по мере приближения к критическому состоянию все характеристики двух фаз (жидкой и газовой) становятся тождественными, причем многие из них претерпевают изменения вплоть до нескольких порядков. Вблизи критической точки значения скрытой теплоты приближаются к нулю, в то время как значения теплоемкости резко возрастают, а равновесное соотношения жидкость – пар становятся равным единице. Поэтому так важно знать, или хотя бы прогнозировать условия наступления у диоксида углерода такого состояния.
Приведенную фазовую диаграмму СО2 можно встретить в большинстве работ. Мы видим, что кривая кипения ограничена критической точкой, выше которой, в большинстве работ, говорится об области сверхкритического флюида, то есть области, в которой выполняются условия Т > Ткрит и Р > Ркрит одновременно, либо выполняется одно из двух условий. Однако в опубликованных работах авторы данный вопрос либо обходят стороной, либо указывают неверные данные, чем вводят читателей в заблуждение. Поэтому не вполне ясно, где именно находится область существования сверхкритического флюида.
Авторы работы «Где Находится Область Сверхкритического Флюида на Фазовой Диаграмме?» довольно подробно отвечают на данный вопрос, и предложенный авторами метод нам кажется наиболее конструктивным. Однако в настоящей работе мы не ставим себе задачей четко определить теоретическую линию фазового перехода, или точную границу околокритической области, мы рассматриваем процесс утилитарно, с точки зрения промышленного производства. Для реального производства удержать дифференциал температуры в процессе +/- 10 градусов – задача практически невыполнимая. Поэтому мы рассматриваем процесс на основе элементарной физики в надежде показать, что критическая область не абстрактна, а имеет определенные границы.
Является фактом, что при Т > Ткрит и Р > Ркрит не происходит мгновенного пересечения линии фазового перехода жидкость – газ. Все свойства вещества меняются непрерывно и чем дальше от критической точки, тем более плавно меняются структура и свойства в системе жидкость – флюид – газ. Если абстрактно рассмотреть структуру СО2, то видно, что при Т>Ткрит происходит разрыв структуры связей между молекулами СО2, но при условии Р > Ркрит разрыв структуры происходит не одномоментно, как на линии кипения ниже критической точки, а постепенно. При Р > Pкрит и Р = const. при постепенным увеличением T в области жидкость – флюид -газ изменение структуры принимает следующий вид:
Жидкость Флюид Газ
Этим объясняется как факт существования флюида и промежуточность его свойств между жидкостью и газом, так и утверждение, что при переходе жидкость – флюид – газ имеет место фазовый переход второго рода. При таком переходе вторые производные термодинамических потенциалов по давлению и температуре изменяются скачкообразно, тогда как их первые производные изменяются постепенно. Отсюда следует, в частности, что энергия и объём вещества не изменяются, но изменяются его теплоёмкость, сжимаемость, и пр. Исходя из этого, мы можем, на основе максимумов теплоемкостей, построить линию жидкость – флюид , и, на основе числа Прандтля, линию флюид – газ. Напомним, что число Прандтля при более низких температурах изменяется, в основном, за счет изменения вязкости. При более высоких температурах изменения, главным образом, происходят за счет теплоемкости. В области флюида резко меняется не только теплоемкость, но и другие физические параметры, однако изменение числа Прандля происходит за счет теплоемкости в результате незначительного изменения отношения вязкости к теплопроводности. Иными словами, число Прандтля незначительно изменяется в зависимости от Т, и, исходя из его значений для трехатомных газов находится в пределе 0,75 ≤ Рг ≤ 1.
Таким образом, в действительности, область сверхкритического диоксида углерода имеет следующий вид (для удобства рассмотрения диаграммы реальные уровни давления заменены их логарифмами. Для простоты понимания соответствующее давление в барах указано в скобках).
Из представленных данных вытекает ряд проблем связанных с экстракцией в области критической точки. Такие аппараты как ректификационные колонны, испарители и конденсаторы, в которых протекают процессы, зависящие от упомянутых свойств, не будут выполнять свои функции, если условия их эксплуатации будут близки к критическим. В случае сверхкритической экстракции, если параметры P и T процесса будут соответствовать критической области, это скажется на свойствах растворителя, и, как следствие, на качестве получаемого продукта.
В производственном процессе достаточно сложно придерживаться точно установленных параметров, особенно в зоне близкой к критической точке, поэтому, при сверхкритической экстракции чаще всего устанавливается значение Т=80⁰С и P=300 атм. Докритическая экстракция проходит при более низких температурах – в области значений Т = 25⁰С и Р = 65 атм.
Характерные для процесса параметры давления и температуры, непосредственно сказываются на составе получаемых экстрактов.
В составе докритических экстрактов достаточно часто могут присутствовать слабополярные соединения, но это обуславливается либо механическим захватом, либо побочными реакциями внутри смеси при хранении. Наличие слабополярных соединений у сверхкритических экстрактов – нормальное явление, так как СО2–флюид при экстракции более эффективно их захватывает. Однако утверждения об экстракции СО2–флюидом всего спектра полярных соединений ничем не обоснованы и не учитывают элементарных физико-химических свойств такого экстрагента. Проведенные нами, совместно с рядом ведущих московских научных центров, исследования позволяют построить следующую таблицу:
Важным является факт, что при сверхкритической экстракции происходит значительное число неуправляемых и неконтролируемых химических реакций, обусловленных наличием особой реакционной среды во время процесса, распадом определенных групп в результате термического воздействия, побочных реакций, а также возможными реакциями в период хранения. Следует сказать, что число вариаций таких реакций весьма велико и рассматривая причины их возникновения, становится очевидным следующее – при увеличении набора химических соединений, с разной физико –химический природой, и ростом температуры количество реакций возрастает в геометрической прогрессии. Наиболее весомым фактором является термическое воздействие более 40 – 45⁰С, при котором происходит частичная, либо полная, потеря ряда свойств у определенных компонентов, входящих в состав экстрактов, в первую очередь – витаминов, а также ускоренное окисление (прогоркание) ненасыщенных жирных кислот.
Кроме распада термолабильных соединений при сверхкритической экстракции намного активней происходит вымывание из сырья высокомолекулярных, относительно тугоплавких соединений. Такая ситуация вынуждает производителей или разбавлять 100%, полные сверхкритические экстракты маслами чтобы придать им потребительскую применимость, или проводить фракционирование, что значительно удорожает экстрактные продукты. В случае простого разбавления в полученных смесях не только остается значительное количество тугоплавких соединений, которые с точки зрения функционального назначения, являются балластом, но и дополнительно стимулируются процессы окисления жирных кислот. В отличие от докритических СО2-экстрактов многие соединения, проявляющие в них антиоксидантную активность, при флюидной экстракции распадаются и, соответственно, теряют способность предохранять жирные кислоты в экстрактах и в производимых с их применением конечных продуктах от окисления. Этим объясняется возникновение «запаха прогоркшего масла» при хранении растворов сверхкритических СО2-экстрактов.
Во всех типах СО2-экстрактов присутствуют соединения, обладающие эмульгирующими свойствами, и способные формировать эмульсии типа вода-в-масле. Поэтому в составах СО2-экстрактов часто присутствуют полярные соединения, которые сами по себе в масляных (неполярных) фазах содержаться не могут. Необходимо отметить, что в докритических СО2-экстрактах таких соединений немного, а при сверхкритических процессах они относительно эффективно экстрагируются и переходят в экстракт. Однако, как только нарушается установившийся баланс между полярной и неполярной фазами, например при добавлении масла, полярные соединения постепенно начинают выпадать из эмульсии – СО2-экстракта. Поэтому очень часто масляные растворы сверхкритических экстрактов после непродолжительно хранения расслаиваются.
Исходя из этого следует, что именно докритическая экстракция, благодаря щадящим технологическим режимам, дает возможность получения универсальных многокомпонентных смесей веществ, наиболее приближенных к исходному составу растения. А физико-химические свойства докритических СО2-экстрактов обеспечивают возможность для их широкого применения, как в качестве натуральных вкусо-ароматических ингредиентов, так и биологических активных добавок при производстве БАДов, фармацевтических препаратов и косметических продуктов.
В то время как сверхкритическая экстракция, будучи менее щадящим, но и более действенным и быстрым инструментом извлечения, может быть рекомендована в качестве специализированного средства, дающего возможность быстро и качественно экстрагировать из исходного сырья необходимые заказчику вещества и группы веществ – в том случае, если они не разрушаются и не загрязняются слишком сильно вследствие достаточно жестких режимов работы, характерных для этого типа СО2-экстракции. Такая возможность может быть востребована для производства фармацевтических субстанций, чистых веществ, комплексов природных витаминов, красителей, консервантов, и многого другого.
Литература:
- Алтунин В.В. Теплофизические свойства двуокиси углерода М., Издательство стандартов. 1975 г., с. 546;
- Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей М., Наука. 1972 г., с. 720;
- В.В. Бражкин, А.Г. Ляпин, В.Н. Рыжов, К. Траченко, Ю.Д. Фомин, Е.Н. Циок УФН, 182, 11 (2012)
- Уэйлес С. Фазовые равновесия в химической технологии: В 2-х частях Мир. 1989 г.,
- Беккер, Г. Домшке, Э. Фангхенель, М. Фишер, К. Гевальд, Р. Майер, Д. Пафель, Г. Шмидт, К. Шветлик, В. Бергер, И. Фауст, Ф. Геяц, Р. Глух, К. Мюллер, К. Шолльберг, Э. Заилер, Г. Цеппенфельд Органикум: в 2-х т. Мир. 1992 г., с. 487.